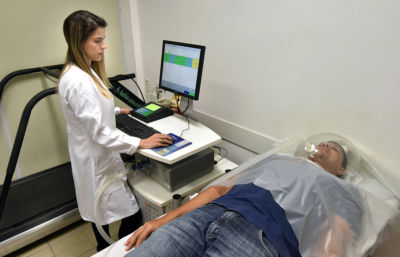
Gasto energético estimado pelo método de Calorimetria Indireta.
A manutenção dos processos vitais em seres humanos é condicionada à energia obtida pela oxidação dos macronutrientes presentes nos alimentos ingeridos diariamente (Diener, 1997; Delsoglio et al., 2019). O equilíbrio entre o gasto e o consumo energético promove a homeostase energética (Levine, 2004; Lam e Ravussin, 2016). O gasto energético (GE) pode ser medido/estimado por vários métodos. Neste post, daremos ênfase à calorimetria indireta respiratória.
Breve abordagem sobre o metabolismo energético
A compreensão dos fatores que influenciam o balanço energético é de fundamental importância para o entendimento da regulação do metabolismo. A produção de energia obtida pela oxidação de macronutrientes presentes nos alimentos, na qual há consumo de oxigênio (O2) e produção de dióxido de carbono (CO2), é utilizada para manutenção de várias funções fisiológicas incluindo respiração, circulação, atividade física e manutenção da temperatura corporal (Gupta et al., 2017).
Nos seres humanos, cerca de 90% da energia ingerida é metabolizável (armazenada em moléculas de alta energia conhecidas como trifosfato de adenosina – ATP), sendo o restante eliminado nas fezes, urina ou pele (forma de calor) (Lam e Ravussin, 2016; Delsoglio et al., 2019).
O gasto energético total (GET) é composto pela taxa metabólica basal (TMB), também conhecida como gasto energético basal (GEB); pelo efeito térmico dos alimentos (ETA) e pelo gasto energético com a atividade física (GAF) (Levine, 2004; Haugen et al., 2007; Avesani et al., 2014; Lam e Ravussin, 2016; Delsoglio et al., 2019; San Martin et al., 2020).
Em situações de equilíbrio energético a ingestão energética equivale ao GET. O desequilíbrio entre estes componentes pode levar ao ganho ou a perda de peso corporal. Quando a ingestão energética é maior que o GET, ocorre balanço energético (BE) positivo, favorecendo o aumento dos estoques energéticos. A situação oposta resulta em BE negativo e consequente depleção das reservas de energia (Rodrigues et al., 2008).

A TMB/GEB representa a quantidade mínima de energia necessária para o corpo humano manter os processos fisiológicos normais, incluindo as atividades metabólicas celulares básicas e as funções dos órgãos, como respiração e manutenção da temperatura corporal na ausência de ingestão recente de alimentos, atividade física e estresse psicológico (Haugen et al., 2007). Corresponde à energia gasta por um indivíduo em repouso na posição supina, pela manhã, após 8 horas de sono e 12 horas de jejum, sem exercícios físicos prévios por 24h, sob condições ambientais confortáveis (Kravchychyn et al., 2011; Oshima et al., 2017; San Martin et al., 2020). Desta forma, a TMB/GEB sofre mínima influência do ETA e do GAF (Volp et al., 2011).
A TMB/GEB pode sofrer variações individuais devido a diferenças em diversos fatores: idade, gênero, altura, peso, nível de atividde física, composição corporal, comorbidades, fatores genéticos, entre outros (Lam e Ravussin, 2016). Corresponde ao principal componente do GET, variando de 60% a 75% na maioria dos indivíduos sedentários (Levine, 2004; Volp et al., 2011; Avesani et al., 2014; Lam e Ravussin, 2016; San Martin et al., 2020; Achamrah et al., 2021).
Conforme descrito acima, as condições ideais para a estimativa da TMB/GEB raramente são atendidas, limitando a sua utilização na prática clínica, pois exige que o avaliado durma durante a noite na unidade metabólica (Volp et al., 2011). Em substituição, normalmente é utilizada a taxa metabólica em repouso (TMR), também denominada gasto energético em repouso (GER), para estimar o GET (Haugen et al., 2007; Oshima et al., 2017).
A TMR/GER corresponde à quantidade de energia utilizada por uma pessoa em 24h, avaliada em repouso aproximado de 15 a 30 minutos, em qualquer período do dia, 4 a 5 h após uma refeição leve, na posição sentada ou supino (San Martin et al., 2020). Estima-se que a TMR/GER possa ser 3-10% (Feurer e Mullen, 1986; Levine, 2004; Volp et al., 2011) ou 10-20% (Avesani et al., 2014) mais elevada do que a TMB devido à termogênese induzida pela alimentação e à influência de prática de atividade física recente. Vários fatores, incluindo composição corporal, peso, frequência cardíaca, idade, sexo, etnia, ciclo menstrual, tabagismo e ingestão de cafeína influenciam a TMR/GER em indivíduos saudáveis (Miller et al., 2013).
O GAF pode ser categorizado em termogênese de atividade relacionada ao exercício (depende se o indivíduo é sedentário ou fisicamente ativo) e termogênese de atividade não-exercício (corresponde a toda energia gasta com ocupação, atividades de lazer, posição sentada ou em pé, deambulação, etc.) (Levine, 2004). Ambas termogêneses variam amplamente de forma inter e intraindividual (San Martin et al., 2020). O GAF é o componente mais variável do GET (Lam e Ravussin, 2016), podendo oscilar de 15% em indivíduos muito sedentários (Levine, 2004; San Martin et al., 2020) até 50% em indivíduos altamente ativos (Levine, 2004). Durante a atividade física, a produção de calor aumenta, estando diretamente relacionada com o volume de massa muscular e com a intensidade do trabalho muscular (Kenny et al., 2017; Gomes e de Miranda Guedes, 2019; Achamrah et al., 2021).
O ETA, outro componente do GET, refere-se ao aumento do dispêndio energético observado após uma refeição e associado ao consumo dos alimentos. Corresponde ao custo energético da mastigação e digestão dos alimentos, absorção e metabolismo dos nutrientes (Lam e Ravussin, 2016; Oshima, et al., 2017). É um componente relativamente estável, representando aproximadamente 10% do GET (Levine, 2004; Avesani et al., 2014; San Martin et al., 2020), podendo variar de acordo com a composição, volume, horário de consumo e modo de preparo dos alimentos (Dias et al., 2009; Lam e Ravussin, 2016).
Métodos para estimativa do gasto energético
São utilizados vários métodos para estimar o GET, entre os quais a calorimetria, equações preditivas, métodos não restritivos tais como frequência cardíaca, diário de atividades e a técnica de isótopos estáveis (água duplamente marcada) (Volp et al. 2011; Lam e Ravussin, 2016). Estes métodos são baseados em princípios diferentes e não medem o mesmo tipo de energia (Kenny et al., 2017). A calorimetria e o método da água duplamente marcada são os métodos mais precisos para estimar as necessidades energéticas e são considerados métodos padrão-ouro (Volp et al., 2011).
O termo calorimetria deriva de duas palavras: do latim calor (calor) e do grego metrion (medir) (Kenny et al., 2017). Corresponde à parte da física que estuda os fenômenos relacionados às trocas de energia térmica. Essa energia em trânsito (transferida de um corpo para o outro) é chamada de calor metabólico. A produção de calor metabólico é expressa como caloria, enquanto a calorimetria se refere à medição da transferência de calor (Archizaet al., 2017; Kenny et al., 2017).
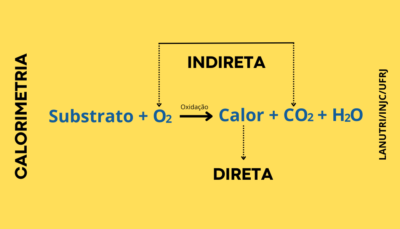
Existem dois métodos de calorimetria (direta e indireta) que são diferenciados pela forma de determinação da energia utilizada pelo metabolismo humano.
Calorimetria direta (CD)
A calorimetria direta é baseada na primeira lei da termodinâmica e nos pressupostos de estabilidade térmica e baixa capacidade de armazenamento de energia, na qual a energia gasta em todos os processos fisiológicos é finalmente dissipada como calor e, portanto, o gasto total de energia pode ser avaliado medindo diretamente a produção de calor (Haugen et al., 2007; Kenny et al., 2017; Oshima et al., 2017; San Martin et al., 2020).
Para a realização deste método, é necessário que o indivíduo esteja em uma câmara isolada do ambiente durante 24 horas, onde pequenas mudanças na temperatura podem ser detectadas com precisão (Diener, 1997; Archiza et al., 2017). Durante o processo é realizada a medição do calor total dissipado pelo corpo como resultado dos metabolismos anaeróbico e aeróbico (Kenny et al., 2017). Embora seja considerado um método padrão-ouro, pois os instrumentos são precisos e sofisticados, a calorimetria direta nunca teve aplicabilidade generalizada devido aos desafios técnicos e altos custos de operação e manutenção e, por isso, está disponível em poucos centros de pesquisa a nível mundial (Kenny et al., 2017; Oshima et al., 2017; Achamrah et al., 2021). Assim, atualmente este método tem aplicabilidade restrita, sobretudo, na validação da calorimetria indireta.
Calorimetria indireta (CI)
A calorimetria indireta respiratória ou simplesmente calorimetria indireta, surgiu desde que Lavoisier e Laplace, no final do século XVIII, chegaram à conclusão de que a quantidade de calor desprendida por um organismo tinha relação com a respiração, que se apresentava como uma combustão, bastante lenta, mas perfeitamente semelhante à do carbono (Archiza et al., 2017; Gomes e de Miranda Guedes, 2019). O método da CI estima a TMR/GER pela determinação do consumo de O2 por meio de um espirômetro e a produção de CO2 do organismo durante um período de tempo (Archiza et al., 2017; Oshima et al., 2017; Kenny et al., 2017; Mtaweh et al., 2018; Delsoglio et al., 2019).
Embora os métodos de CD e CI tenham limitações inerentes, ambas são técnicas valiosas para avaliar o GE. No entanto, é importante lembrar que esses métodos não avaliam o mesmo tipo de energia. Enquanto a CD mede a produção de calor que resulta das reações biológicas, a CI mede o consumo de O2 e a produção de CO2 que resulta destas reações (Archiza et al., 2017; Kenny et al., 2017; Oshima et al., 2017; Mtaweh et al., 2018; Delsoglio et al., 2019).
Princípios da Calorimetria Indireta
Os processos metabólicos em humanos resultam na produção de calor onde a taxa de produção de calor define o metabolismo energético (Archiza et al., 2017; Kenny et al., 2017).
A produção de energia deriva da conversão da energia que é liberada dos nutrientes (combustão biológica), através da oxidação dos substratos alimentares. Os nutrientes à base de carbono (ou seja, combustíveis) são convertidos em CO2, água (H2O) e calor na presença de O2 [substrato + O2 oxidação = CO2 + H2O + calor] (Haugen et al., 2007; Gupta et al., 2017; Mtaweh et al., 2018; Delsoglio et al., 2019; Gomes e de Miranda Guedes, 2019).
A energia química liberada dos substratos alimentares é armazenada nas ligações de macromoléculas (ex: glicogênio muscular e hepático) e ATP. Quando a atividade física e outros processos metabólicos são realizados, essa energia química é convertida em energia mecânica e calor durante os processos de oxidação. Em estado de repouso de termoneutralidade, a perda de calor do corpo é igual à produção de calor metabólico dos processos oxidativos no corpo (Kenny et al., 2017). A taxa de produção de energia é proporcional à taxa do consumo de O2.
A premissa básica da CI é medir a diferença nos teores de O2 e CO2 entre o ar expirado e o inspirado pelos pulmões durante o ciclo respiratório que, juntamente com a ventilação por minuto, permite quantificar o consumo de O2 (VO2 em L/min) e a produção de CO2 (VCO2 em L/min) (Haugen et al., 2007; Gupta et al., 2017; Kenny et al., 2017; Oshima et al., 2017; Delsoglio et al., 2019).
O VO2 (L/min) e o VCO2 (L/min) são posteriormente utilizados para calcular (estimar) a TMR/GER (kcal/dia) usando tradicionalmente a equação de Weir (Weir, 1949) modificada.
Equação completa de Weir
Produção de calor (kcal/min/dia) = [VO2 (L/min) x 3,941] + [VCO2 (L/min) x 1,106] – (uN2 (g/dia) x 2,17]
TMR/GER (kcal/dia) = produção de calor × 1440 min
O componente de nitrogênio urinário (uN2) é frequentemente excluído ao calcular o gasto de energia em decorrência da sua baixa expressividade energética durante a situação de repouso (Feurer e Mullen, 1986; Delsoglio et al., 2019). Assim, a equação abreviada é comumente aplicada para estimar o GER (Haugen et al., 2007; Gupta et al., 2017; Delsoglio et al., 2019).
Equação de Weir modificada
Produção de calor (kcal/min/dia) = [VO2 (L/min) x 3,941] + [VCO2 (L/min) x 1,106]
TMR/GER (kcal/dia) = produção de calor × 1440 min
Por esse método também é possível determinar o quociente respiratório (QR) ou índice de troca respiratória, que reflete a relação entre o VCO2 expirado e o VO2 consumido durante um período de tempo [QR = VCO2/VO2]. O QR possibilita identificar os principais substratos (lipídios, carboidratos ou proteína) ou a mistura de substratos que está sendo preferencialmente oxidada no momento em que o exame é realizado (Rodrigues et al., 2008; Avesani et al., 2014; Gupta et al., 2017; Delsoglio et al., 2019).
O QR pode ser dividido em QR não-proteico, que reflete a participação dos carboidratos e lipídios, e QR proteico, que representa a utilização de proteínas. A taxa de oxidação proteica é obtida pela determinação da quantidade de nitrogênio excretado na urina ou utilizando-se a constante de excreção de nitrogênio de 0,14 g/kg/dia (Jéquier et al., 1987; Jones e Schoeller, 1988; Diener, 1997).
O valor preciso da utilização de O2 varia ligeiramente dependendo do substrato metabólico predominante. Sob condições metabólicas padrão com função respiratória estável, a faixa de variação do QR em humanos é de 0,7 a 1, com 0,7 representando predominantemente a oxidação de lipídios, 0,8 a oxidação de proteínas, 0,85 a dieta mista e 1 a oxidação de carboidratos (Feurer e Mullen, 1986; Diener, 1997; Gupta et al., 2017; Mtawehet al., 2018). Durante o metabolismo de carboidratos, os volumes de CO2 produzido e de O2 consumido são equivalentes (são necessárias seis moléculas de O2, o que dá origem à produção de 6 moléculas de CO2), resultando em um QR = 1,0. Os lipídios possuem uma grande proporção da ligação carbono-hidrogênio em relação aos carboidratos, por isso produzem mais ATP na respiração. Logo, durante o metabolismo dos lipídios, há menos CO2 produzido para O2 consumido (QR = 0,7) (San Martin et al., 2020). Assim, dependendo do substrato oxidado, o valor de QR tende a variar.
Equipamentos de Calorimetria Indireta
O equipamento utilizado para medir o GE pelo método da calorimetria designa-se por calorímetro. De acordo com o princípio de funcionamento, os calorímetros são classificados em equipamentos de circuito “fechado” e de circuito “aberto” (Diener, 1987), sendo o segundo o mais utilizado (Mtaweh et al., 2018). Ambos são empregados para realizar medidas metabólicas de VO2 e VCO2.
- No circuito fechado, o avaliado é conectado a um sistema de válvulas direcionais no qual ele respira continuamente o ar com composição conhecida, vindo de cilindros/reservatórios, por meio do espirômetro. O VO2 pode ser determinado a partir das alterações volumétricas do sistema, durante a realização do exame (Diener, 1997; Dias et al., 2009; Kravchychyn et al., 2011; Archiza et al., 2017; Mtaweh et al., 2018). Embora ainda utilizados para estudos de calorimetria de pequenos animais, poucos equipamentos para uso humano empregam este princípio (Diener, 1997).
- Na forma de circuito aberto, ambos os extremos do sistema se comunicam com o ambiente. O avaliado é conectado e respira por uma válvula de duas vias. Por uma das vias é inspirado o ar ambiente, e pela outra o ar expirado é coletado por sensores de fluxo eletrônico e analisado por meio de software (Dias et al., 2009; Kravchychyn et al., 2011; Archiza et al., 2017; Kenny et al., 2017). Dependendo do modelo, dos acessórios e componentes utilizados, esses equipamentos podem realizar medições em indivíduos respirando espontaneamente através de máscara de silicone/neoprene, bucal e clipe nasal ou campânula ventilada (canopy), e também em pacientes que estão em ventilação mecânica, por meio de conexão de tubo endotraqueal ao ventilador (Diener, 1987; Achamrah et al., 2021; Byerly e Yeh, 2022).
Tradicionalmente os equipamentos de CI para respiração espontânea usam coletores de gases, incluindo campânula ventilada (canopy) com válvula unidirecional, que mede o volume e as concentrações de O2 e CO2 por minuto com o mínimo de desconforto para o avaliado (Rodrigues et al., 2008; Volp et al., 2011; Oshima et al., 2017). Importante salientar que vazamentos aéreos de gases respiratórios durante a realização do exame alteram a precisão das medições, bem como a falta de manutenção periódica do equipamento (Oshima et al., 2017). Em decorrência da sua complexidade e alto custo, esses equipamentos estão disponíveis principalmente em ambientes de internação e pesquisa e raramente no ambiente clínico (Dias et al., 2009; Oshima et al., 2017; Rattanachaiwong e Singer, 2019; Achamrah et al., 2021).
Com os avanços tecnológicos e o desenvolvimento de equipamentos portáteis a custos acessíveis, o método de CI tem sido cada vez mais utilizado nas áreas clínica e esportiva para aperfeiçoar o cuidado nutricional (Achamrah et al., 2021; Byerly e Yeh, 2022).
Alguns dispositivos simplificados de CI disponíveis comercialmente medem apenas o VO2 ou VCO2 para estimar o gasto de energia. Além disso, eles assumem um QR constante (por exemplo, 0,80-0,85) para todos os indivíduos (Haugen et al., 2007; Oshima et al., 2017). Estes dispositivos têm a vantagem da mobilidade e baixo custo, sendo aceitável em pessoas saudáveis com alimentação balanceada. Contudo, não são recomendados para pacientes hospitalizados uma vez que a oxidação do substrato pode mudar significativamente de acordo com o tipo de doença e nutrição (Oshima, et al., 2017).
Importante salientar que o calorímetro requer manutenção programada regularmente. A nova tecnologia facilitou o uso e a manutenção dos calorímetros indiretos. Os requisitos de manutenção são baseados no tipo de dispositivo e nas especificações do fabricante. A calibração é o aspecto mais importante da manutenção. Detectar um pequeno desvio na calibração pode ser difícil, mas pode afetar os resultados do exame de forma significativa (Rattanachaiwong e Singer, 2019).
Aplicações do exame de Calorimetria Indireta
A CI é um método não invasivo que demonstrou ser bem-sucedido na determinação do gasto de energia (TMR/GER), superando as limitações das equações preditivas e tornando-se o padrão-ouro em várias configurações (Volp et al., 2011; Rattanachaiwong e Singer, 2019; San Martin et al., 2020). Atualmente, é um método amplamente utilizado, especialmente em centros de pesquisa, tendo contribuído nos últimos dois séculos para os avanços no conhecimento e compreensão da nutrição e bioenergética, termogênese, metabolismo energético durante o exercício físico e em situações patológicas, entre outras (Kenny et al., 2017; Gomes e de Miranda Guedes, 2019).
A otimização do fornecimento de energia é um dos pilares do suporte nutricional (Achamrah et al., 2021). A literatura demonstra que mudanças no GE, em vários estágios da doença, podem revelar informações metabólicas ocultas que podem ser traduzidas em dados clínicos e têm o potencial de serem indicadores prognósticos e/ou alvos de tratamento (Dias et al., 2009; Kravchychyn et al., 2011; Rattanachaiwong e Singer, 2019).
A CI oferece uma abordagem com base científica para maximizar os benefícios da terapia nutricional com aplicação direta no planejamento e na monitoração da intervenção dietética, fornecendo informações personalizadas sobre mudanças no GE (Haugen et al., 2007; Dias et al., 2009). A avaliação do GE não apenas fornece uma opção para avaliar as necessidades nutricionais individuais, mas também corresponde a um atributo clínico capaz de subsidiar soluções claras que permitem ao nutricionista ajustar a prescrição calórica, bem como monitorar a evolução de dietas prolongadas em diferentes estágios de doença, contribuindo com impacto positivo do suporte nutricional (Haugen et al., 2007; Oshima et al., 2017; Delsoglio et al., 2019; Rattanachaiwong e Singer, 2019; San Martin et al., 2020; Achamrah et al., 2021; Byerly e Yeh, 2022).
Também é crescente a utilização da CI na prescrição e acompanhamento de treinamentos atléticos e exercícios físicos sistematizados, no intuito de se avaliar o consumo máximo de O2, e a partir deste predizer o grau de condicionamento físico dos indivíduos e prescrever exercícios físicos de forma personalizada (Kravchychyn et al., 2011).
Importância do Protocolo para realização do exame de Calorimetria Indireta
Independentemente do método de CI ser considerado padrão-ouro na predição do gasto metabólico, o protocolo para a realização do exame deve ser previamente definido, pois influenciará profundamente a acurácia dos resultados obtidos (Volp et al., 2011; Oshima et al., 2017). A avaliação é bem-sucedida quando um equipamento adequado é usado em condições ideais (protocolo) e os resultados são analisados por profissionais capacitados para individualizar o cuidado nutricional. Não seguir o protocolo resulta em resultados altamente variáveis e imprecisos.
Os procedimentos operacionais padrão dependem do equipamento utilizado, bem como dos propósitos da realização do exame. No entanto, as etapas abaixo são geralmente necessárias.
O equipamento deve ser ligado, no mínimo, 30 minutos antes da realização do exame, para aquecimento e estabilização adequados. Os analisadores de O2 e de CO2 devem ser calibrados com gás de concentração conhecida como referência antes de cada determinação e, periodicamente, validados conforme as especificações do fabricante (Dias et al., 2009).
O avaliado não deve ter praticado atividades físicas antes do exame (2h para atividades moderadas e no mínimo 14h para atividades vigorosas com atenção especial para treinamento cardiovascular e de força); deve estar em estado de repouso (pelo menos 15 minutos antes do início do exame); livre de estresse físico e psicológico; em ambiente termicamente neutro/confortável (temperatura onde a energia usada para a manutenção da temperatura corporal é mínima); em estado de jejum (pesquisas: abstenção de alimentos e bebidas por no mínimo 6 h antes do exame; prática clínica: 2 a 4 h); e em abstenção de nicotina por 2 horas. Essas medidas são importantes para minimizar o impacto do gasto de energia relacionado à atividade física, à termogênese induzida pela dieta e a outros fatores (Compher et al., 2006; Oshima et al., 2017).
Posicionar o avaliado e conectar os acessórios de forma adequada e realizar o monitoramento ao longo do exame, assegurando que não haja vazamentos nas conexões do circuito respiratório (Dias et al., 2009).
A duração total do exame de CI também é um fator importante (Achamrah et al., 2021). Em geral, o exame tem duração de 30 minutos, após os procedimentos necessários para calibração do sistema. A maioria dos procedimentos é iniciada após um intervalo de tempo predeterminado ou até que o “estado estacionário” seja atingido. O estado estacionário representa um período de “equilíbrio metabólico” e é definido por critérios mais rigorosos, como por exemplo, um intervalo de 5 minutos durante o qual VO2 e VCO2 variam menos de 10% ou o coeficiente de variação para esses dois valores é menor que 5% (Feurer e Mullen, 1986).
Ademais, é fundamental estabelecer no protocolo de exames procedimentos de higienização para todos os acessórios ou componentes do equipamento que entrem em contato com o avaliado.
© 2023 | Todos os direitos deste material são reservados ao LANUTRI/INJC, conforme a Lei nº 9.610/98.
Link para matéria: https://lanutri.injc.ufrj.br/2023/01/27/calorimetria-indireta/
Referências
Achamrah, N., Delsoglio, M., De Waele, E., Berger, M. M., Pichard, C. Indirect calorimetry: The 6 main issues. Clin Nutr. 2021 Jan; 40(1): 4-14.
Archiza, B., Welch, J. F., Sheel, A. W. Classical experiments in whole-body metabolism: closed-circuit respirometry. Eur J Appl Physiol. 2017 Oct; 117(10): 1929-1937.
Avesani, C.M., Santos, N.S.J., Cuppari, L. Necessidades e recomendações de energia. In: Cuppari L – Nutrição Clínica no adulto. Ed. 3. São Paulo: Manole; 2014. p. 45-62.
Byerly, S. E., Yeh, D. D.The Role of Indirect Calorimetry in Care of the Surgical Patient. Current Surgery Reports. 2022; 1-6.
Compher, C., Frankenfield, D., Keim, N., Roth-Yousey, L. Best practice methods to apply to measurement of resting metabolic rate in adults: a systematic review. J Am Diet Assoc. 2006; 106(6):881-903.
Delsoglio, M., Achamrah, N., Berger, M. M., Pichard, C. Indirect Calorimetry in Clinical Practice.J Clin Med. 2019 Sep5;8(9): 1387.
Dias, A. C. F., Silva Filho, A. A., Cômodo, A. R. O., Tomaz, B. A., Ribas, D. F., Spolidoro, J., Marchini, J. S. Gasto energético avaliado pela calorimetria indireta. Projeto Diretrizes. Associação Médica Brasileira e Conselho Federal de Medicina. 2009; 1-13.
Diener, J. R. Calorimetria indireta. Rev Assoc Med Bras. 1997 Jul-Sep; 43(3): 245-53.
Feurer, I. D., Mullen, J. L. Bedside measurement of resting energy expenditure and respiratory quotient via indirect calorimetry. NutrClinPract.1986;1:43–9.
Gomes, M. J. M., de Miranda Guedes, C. V. Antoine Lavoisier. Contributos para o conhecimento do metabolismo energético. História da Ciência e Ensino: construindo interfaces, 2019; 20: 202-212.
Gupta, R.D., Ramachandran, R., Venkatesan, P., Anoop, S., Joseph, M., Thomas, N. Indirect Calorimetry: From Bench to Bedside. Indian J Endocrinol Metab. 2017 Jul-Aug; 21(4):594-599.
Haugen HA, Chan LN, Li F. Indirect calorimetry: a practical guide for clinicians. Nutr Clin Pract. 2007 Aug;22(4):377-88.
Jéquier E, Acheson K, Schutz Y. Assessment of energy expenditure and fuel utilization in man. Ann Rev Nutr. 1987; 7:187-208.
Jones, P. J., Schoeller, D. A. Polyunsaturated:saturated ratio of diet fat influences energy substrate utilization in the human. Metabolism. 1988 Feb; 37(2): 145-151.
Kenny, G. P., Notley, S. R., Gagnon, D. Direct calorimetry: a brief historical review of its use in the study of human metabolism and thermoregulation. Eur J Appl Physiol. 2017 Sep; 117(9): 1765-1785.
Kravchychyn, A. C. P., Kravchychyn, C., Barbosa, C. P. Mensuração do Metabolismo pelo Método de Calorimetria Indireta. Saúde e Pesquisa. 2011; 4(1).
Lam, Y. Y., Ravussin, E. Analysis of energy metabolism in humans: A review of methodologies. Molecular metabolism. 2016; 5(11): 1057-1071.
Levine J.A. Non-exercise activity thermogenesis (NEAT). Best Pract Res ClinEndocrinolMetab. 2002 Dec; 16(4):679-702.
Miller, S., Milliron, B. J., Woolf, K. Common Prediction Equations Overestimate Measured Resting Metabolic Rate in Young Hispanic Women. Top Clin Nutr. 2013 Apr; 28(2): 120-135.
Mtaweh, H., Tuira, L., Floh, A. A., Parshuram, C. S. Indirect Calorimetry: History, Technology, and Application. Front Pediatr. 2018 Sep 19; 6:257.
Oshima T., Berger M. M., De Waele, E., Guttormsen, A.B., Heidegger, C. P., Hiesmayr, M., Singer, P., Wernerman, J., Pichard, C. Indirect calorimetry in nutritional therapy.A position paper by the ICALIC study group.ClinNutr. 2017 Jun; 36(3):651-662.
Rattanachaiwong, S., Singer, P. (2019). Indirect calorimetry as point of care testing. Clinical nutrition.2019; 38(6): 2531-2544.
Rodrigues A.E, Marostegan P.F, Mancini M.C, Dalcanale L, Melo M.E, Cercato C, Halpern A. Análise da taxa metabólica de repouso avaliada por calorimetria indireta em mulheres obesas com baixa e alta ingestão calórica. Arq Bras Endocrinol Metabol. 2008 Feb; 52(1):76-84.
San Martin, R., Brandão, C. F. C., Junqueira-Franco, M. V. M., Junqueira, G. P., Chueire, F. B. Conceitos da calorimetria indireta sobre distúrbios metabólicos: uma revisão narrativa. RevMed (São Paulo), 2020; 99(6): 581-90.
Volp, A. C. P., Oliveira, F. C. E., Esteves, Alves, R.D.M., R., Esteves, E. A., Bressan, J. Energy expenditure: components and evaluation methods. Nutricionhospitalaria. 2011; 26(3): 430-440.
Weier, J. B. New methods for calculating metabolic rate with special reference to protein metabolism.J Physiol. 1949 Aug; 109(1-2): 1-9.


